Mehrsprachig
Übersetzungs-Workflows
Versionskontrolle
Audit-Historie
eTD-Datenmodell
Fokus auf Inhalte
MS Office
Vollständige Integration
Vollständiges DMS
Intelligente Dokumente
Analyse der Auswirkungen
Live-Verfolgung
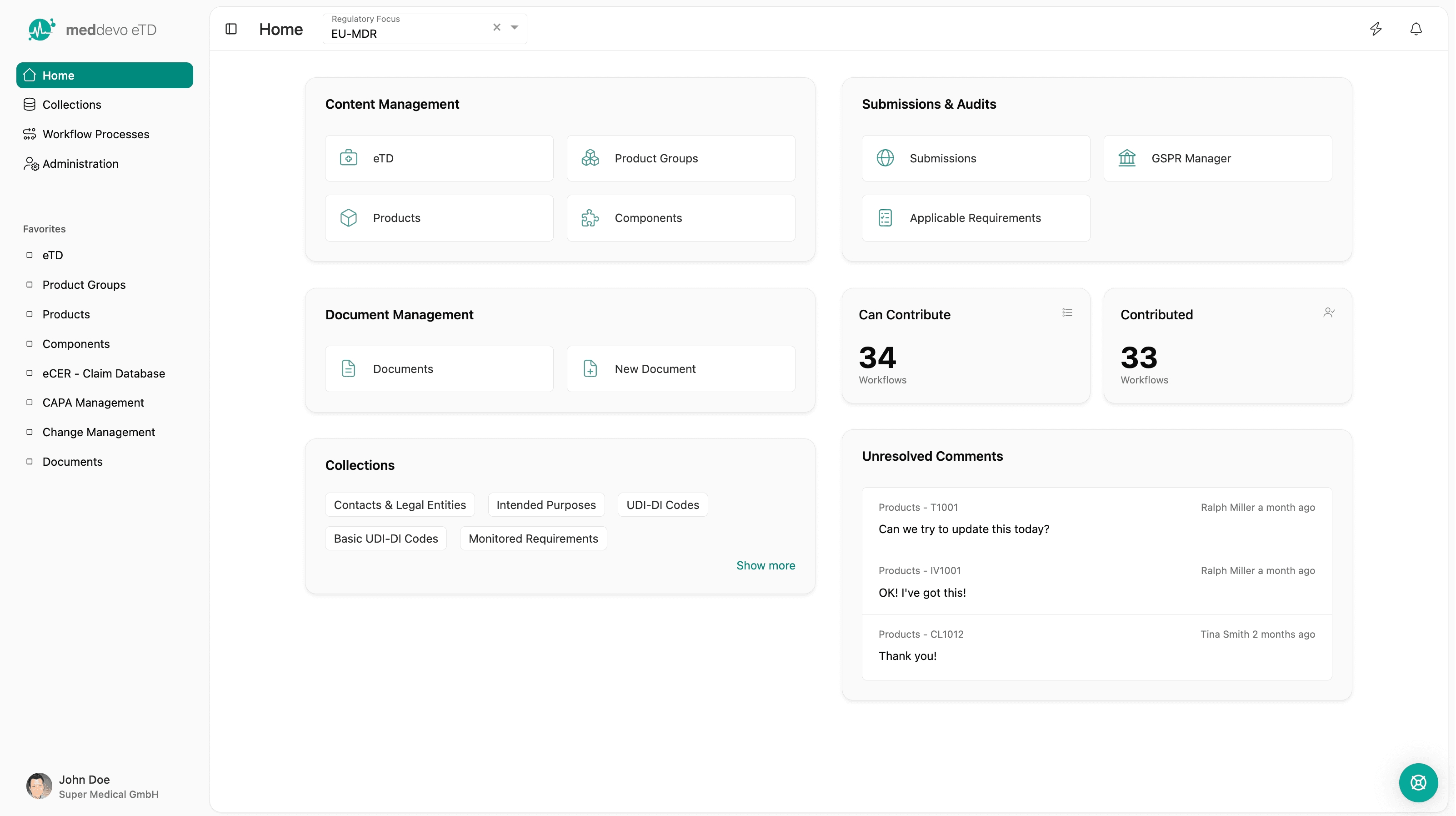
meddevo eTD
Inhaltsbasierte technische Dokumentation für Medizinprodukte und IVDs
meddevo eTD ersetzt die dokumentenbasierte technische Dokumentation durch ein strukturiertes regulatorisches Datenmodell. Entwickelt für Medizinprodukte- und IVD-Hersteller, die ihre Portfolios über Märkte, Produkte und Vorschriften hinweg skalieren.
Warum die herkömmliche technische Dokumentation im großen Maßstab versagt
Technische Dokumentation wurde nie für wachsende gesetzliche Anforderungen oder für die Skalierung von Portfolios konzipiert.
Exponentiales Wachstum der Redundanzen
Zunehmender manueller Aufwand und Fehler
Längere Zeit bis zur Markteinführung
Begrenzte Transparenz
Abhängigkeit von einzelnen Experten
Dokumentenmanagementsysteme speichern Dateien.
QM Systeme kontrollieren Prozesse.
Design Tools können entwickeln.
Aber keines dieser Systeme versteht regulatorische Logik und Anforderungen.
eTD wurde für genau diese Zwecke entwickelt.
Was eTD grundlegend ändert
Von Dokumenten zu strukturierten regulatorischen Daten
Anstatt Dokumente zu bearbeiten, behalten Sie den Überblick:
Die Dokumente werden automatisch aus freigegebenen Daten generiert und bleiben durchgehend konsistent.
Dadurch wird die regulatorische Arbeit von einer reaktiven Dokumentenpflege zu einem kontrollierten Datenmanagement.
Ein Datenmodell. Vollständige regulatorische Kontrolle.
Das meddevo eTD-Datenmodell wurde seit 2018 speziell für Medizinprodukte und IVDs entwickelt und ist mit regulatorischen Anforderungen vorkonfiguriert.
Vollständige Nachverfolgbarkeit. Tages aktuelle Auswirkungsanalyse. Sie wissen immer, was sich ändert, wo es verwendet wird und welche Einreichungen davon betroffen sind.
Bevor Sie einreichen. Bevor Sie prüfen. Bevor das Risiko eskaliert.
Was eTD ermöglicht
Strukturierte regulatorische Daten anstelle statischer Dokumente
Automatisierte Dokumentenerstellung aus validierten Inhalten
Vollständige Rückverfolgbarkeit, Auswirkungsanalyse und Redlining von Dokumenten vor Änderungen
Ermöglicht sichere KI-Anwendungsfälle auf Basis von Daten
Plattform-Module
eTD-Datenmodell
Mehrsprachiges TD Content Management
medtech DMS
Dokumenten Management System
eStandards
Überwachung von Normen und MDCG Dokumenten
eSubmission
Regulatorische Einreichungen
UDI-Management
Device Identification
GSPR-Manager
Sicherheitsanforderungen
Risikomanagement
Einhaltung der ISO 14971
Klinische Bewertung
CER-Dokumentation
eTD-Datenmodell
Mehrsprachiges TD Content Management
medtech DMS
Dokumenten Management System
eStandards
Überwachung von Normen und MDCG Dokumenten
eSubmission
Regulatorische Einreichungen
UDI-Management
Device Identification
GSPR-Manager
Sicherheitsanforderungen
Risikomanagement
Einhaltung der ISO 14971
Klinische Bewertung
CER-Dokumentation
Entdecken Sie alle Module und Möglichkeiten der eTD-Plattform
Entdecken Sie alle eTD-FunktionenEntwickelt für echte Regulatory Affairs Teams
Standardmäßig Enterprise-fähig
meddevo eTD skaliert von einzelnen Produkten bis zu globalen Portfolios.
Alle Funktionen erkundenPläne, die sich an Ihre Bedürfnisse anpassen
Finden Sie den richtigen Plan für Ihr Unternehmen.
Starter
Am besten für kleine Teams
2-4 Nutzer
- Vollständiges eTD-Datenmodell
- Vollständiges DMS- und MS Office-Integration
- Digitale Freigabe-Workflows
- Intelligente Dokumentenerstellung
- Compliance-Inspektor
- In-App-Unterstützung
- und vieles mehr...
- Entdecken Sie alle eTD-Funktionen →
PRO
Geeignet für kleine Unternehmen und KMU
Ab 4 Benutzern
- eSubmissions
- Normen-Überwachung
- Benutzerdefinierte Prozesse
- REST-API-Zugang
- Persönlicher Kundenbetreuer
- und viele mehr...
- Entdecken Sie alle eTD-Funktionen →
Verwendet von Unternehmen wie
Enterprice
Für große Unternehmen und ihre Komplexität
Ab 10 Benutzer
- Unbegrenzte benutzerdefinierte Sammlungen (Collections)
- Mehrere Workspaces
- SSO
- und viele mehr...
- Entdecken Sie alle eTD-Funktionen →
Verwendet von Unternehmen wie
Ein geführter Weg, kein blindes Ausrollen
Jede eTD-Implementierung beginnt mit einem strukturierten Evaluierungs- und Onboarding-Prozess.
Erkunden Sie reale Use Cases
Migration von Altdokumentation mit KI-Unterstützung
Vom ersten Tag an von unseren Regulatory Experten begleitet
Aufbau eines validierten und skalierbaren Systems
Sind Sie bereit, Ihre technische Dokumentation in einen strategischen Vorteil zu verwandeln?
meddevo eTD ist mehr als ein Werkzeug.
Es ist die Grundlage für digitale regulatorische Prozesse.
Beginnen Sie dort, wo Sie sind. Skalieren Sie, wenn Sie bereit sind.